av 巨乳 施一公运筹帷幄组初次报说念γ-分泌酶抑止剂和颐养剂的分子机制
发布日期:2024-12-12 03:46 点击次数:115

阿尔兹海默症(Alzheimer’s disease)简称AD,亦称老年死板症,是刻下天下鸿沟内患病最日常,病情最严重的神经退行性疾病。临床阐扬为驰念缺失、通顺功能劳作,终末脑功能严重丧失直至死亡。跟着年齿的加多,该疾病的发病概率缓缓增大,统计标明,在65岁以上东说念主群中,其发病率高达10%,在85岁以上东说念主群中,发病率更是达到30-50%。然则到刻下为止,该疾病莫得任何殊效药物,提神挨次和颐养妙技齐严重不及,给病东说念主过甚家东说念主变成极大的晦气av 巨乳,也为社会带来千里重的包袱。
AD病东说念主的特异性象征物之一是脑组织中出现的淀粉样斑块千里积,它是由淀粉样卵白前体卵白(APP, amyloid precursor protein)被γ-分泌酶(γ-secretase)切割后产生的Aβ多肽缓缓齐集形成的。γ-分泌酶是由四种亚基Presenilin1(PS1)、Pen-2、Aph-1和Nicastrin(NCT)共同组成的膜内卵白酶复合物。遗传学左证标明,可遗传的家眷性AD所佩戴的基因突变中有200多个突变位于编码γ-分泌酶活性亚基PS1的基因上。一直以来,抑止γ-分泌酶的切割活性,减少淀粉样斑块千里积齐是一个进犯的颐养AD的计策,许多针对AD药物的研发径直以γ-分泌酶算作靶点,但愿通过颐养其活性来颐养疾病,一些药物曾经参预临床II期或III期磨真金不怕火。相配缺憾的是,这些药物竟无一例外地宣告失败,AD药物研发规模倍受障碍。
礼来公司研发的小分子药物Semagacestat是最为著明的案例:Semagacestat是第一个参预临床三期磨真金不怕火的γ-分泌酶抑止剂,该小分子药物由于其前期磨真金不怕火的显赫成果倍受爱护;但是临床三期磨真金不怕火放弃高慢,该药物并未减慢疾病发展,并且还会导致患者贯通才和洽日常行为才调拖沓。除此除外,Semagacestat还会擢升病东说念主患皮肤癌的风险,这很有可能是由于这种抑止剂不仅抑止APP的切割,还抑止了γ-分泌酶另外一种进犯底物—Notch的切割,因此合理地想象对APP和Notch具有底物选定性的γ-分泌酶抑止剂具有进犯的价值。然则一直以来γ-分泌酶与其小分子药物的原子分辨率结构的缺失使得进一步的药物想象与优化濒临着很大的防碍。
2020年12月28日,施一公诠释团队在线发表“小分子药物抑止及颐养γ-分泌酶的结构基础”(Structural Basis of γ-Secretase Inhibition and Modulation by Small Molecule Drugs)的著作[1],第一次报说念了γ-分泌酶结合三种小分子抑止剂(Gamma-Secretase Inhibitor, GSI)和一种颐养剂(Gamma-Secretase Modulator, GSM)的四个原子分辨率冷冻电镜结构,发扬了γ-分泌酶识别不同种类抑止剂及颐养剂的分子机理。科研东说念主员通过与2015年理解的γ-分泌酶的结构,以及2019年γ-分泌酶分辩结合底物Notch与APP两种景况进行比拟分析,初次齐全展现了γ-分泌酶结合底物与药物的全经过,为了解γ-分泌酶活性颐养机制提供了前所未有的精确蓝图,也将极地面鼓励下一代γ-分泌酶抑止剂及颐养剂的想象与优化。

失败是到手之母,只好明白了为什么失败,才能累积造就,通向到手。在该运筹帷幄中,施一公教讲课题组领先理解了γ-分泌酶与Semagacestat的3.0 Å分辨率结构。Semagacestat在γ-分泌酶中与底物结合γ-分泌酶所形成的β-strand占据着酌量的位置,对底物参预γ-分泌酶活性中心形成了位阻。值得一提的是,底物Notch与APP所形成的β-strand均会被Semagacestat碎裂,这一放弃到手地解释了Semagacestat抑止γ-分泌酶活性的机制,也一目了然地证明了Semagacestat产生反作用的机制。
接下来的运筹帷幄中,解释对APP和Notch具有一定选定性的抑止剂怎样结合γ-分泌酶,关于配置或优化特异性抑止剂兴致要紧。施一公教讲课题组选定了参预到临床II期由BMS公司研发的Avagacestat进行运筹帷幄,到手理解了γ-分泌酶结合Avagacestat的3.1 Å的结构。出乎预念念的是,Avagacestat也占据着底物的β-strand的位置,但是在与PS1的具体相互作用方面与Semagacestat有所不同。Avagacestat主要与PS1的疏水残基存在相互作用,只形成了一个氢键,而Semagacestat不错形成四个氢键。结合Avagacestat与结合Semagacestat后的PS1的构象有一定区别,呈现出更为“松散”的景况,Avagacestat的底物选定性大约和这些相互作用形势的不同研究。
橾在线观看Semagacestat和Avagacestat齐是γ-分泌酶抑止剂中的非过渡景况相似物(non-transition state analog,non-TSA),除此除外,还有过渡景况相似物(transition state analog,TSA)抑止剂。为了更全面的文书扫数类型抑止剂的作用机理,他们进一步理解了γ-分泌酶结合TSA抑止剂L685,458的的结构。在γ-分泌酶运筹帷幄规模,L685,458具有独到的地位,因为许多用于运筹帷幄γ-分泌酶构象变化的化学器用齐是L685,458的生息物。预念念之中,L685,458的一部分也具有与前边两种抑止剂酌量的空间占位。不同之处在于,L685,458 还不错与γ-分泌酶的两个天冬氨酸催化残基存在径直相互作用,意见的捕捉到了天冬氨酸水解酶催化经过中形成“正四面体”中间态的构象。
至此,该运筹帷幄到手揭示了三种不同的γ-分泌酶抑止剂的作用机理,分析了其共同点,更进犯的是揭示了三者之间的区别,为往时优化和想象具有底物特异性的抑止剂奠定了坚实基础。
然则抑止机理的运筹帷幄仅仅γ-分泌酶活性颐养的一个设施,在以γ-分泌酶为靶点的小分子药物想象规模,还有另一类拦阻淡薄的小分子,即γ-分泌酶活性颐养剂(GSMs)。γ-分泌酶颐养剂(GSMs)在AD药物的研发方面也具有很大的后劲。与GSI不同的是,GSMs并演叨足抑止γ-分泌酶切割活性,而是一定进度上促进毒性较强的Aβ42的进一步切割,形成更为安全的Aβ38等更短的多肽,缓解淀粉样斑块的形成。因此GSMs大约不错辅助GSIs以达到更优的切割着力和底物选定性。E2012是一种杂环类化合物,它不错和L685,458同期结合γ-分泌酶达到更高的抑止成果。该运筹帷幄中展示了γ-分泌酶和E2012、L685,458的冷冻电镜结构,分辨率高达2.6 Å。E2012像一把匕首,一侧插入到PS1和NCT共同形成的结合空腔中,这亦然初次明确了γ-分泌酶结合GSM的位点。E2012结合后不错和PS1的loop1形成氢键,loop1与γ-分泌酶的底物也存在相互作用。对比底物结合的构象,E2012空间上对底物跨膜螺旋的一侧具有一定的位阻效应,但演叨足重合,这与抑止剂是有暴露区别的。这种位阻效应,客不雅上组成了底物跨膜螺旋两个方针的通顺趋势,为解释E2012促进Aβ42切割成Aβ38的别构颐养机制提供了结构基础。
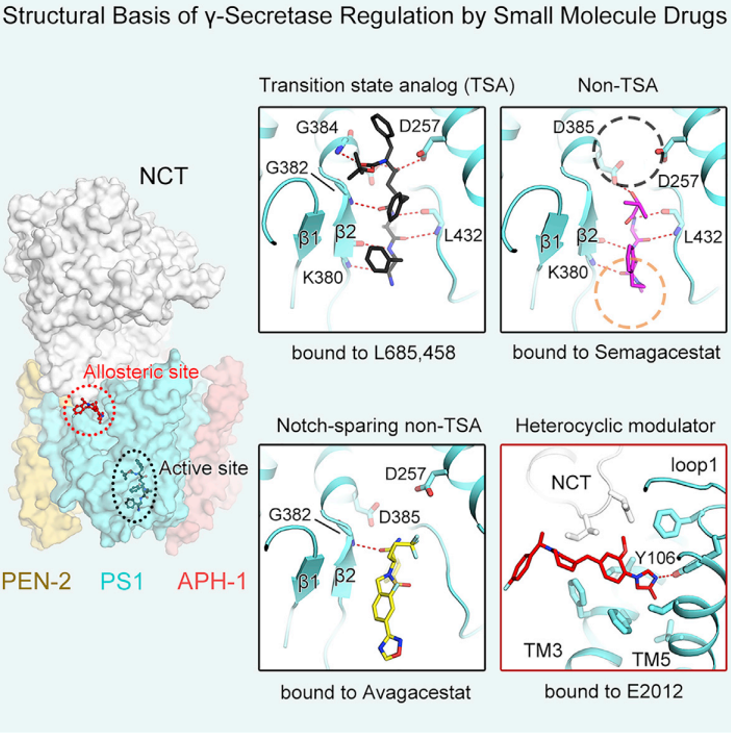
γ-分泌酶结合三种小分子抑止剂(Semagacestat、Avagacestat和L685,458)和一种颐养剂(E2012)的原子分辨率冷冻电镜结构。三种小分子抑止剂结合在酌量的位置,占据底物β-strand的位置,与PS1的β-strand相互作用。颐养剂E2012结合在另外一个別构颐养位置。
施一公诠释本质室一直以来齐将揭示阿尔兹海默症的发病机理算作要点运筹帷幄方针,其中与AD关系的进犯卵白γ-分泌酶的三维结构过甚作用机理的理解是一项进犯的设施。2012年,施一公诠释过甚团队在Nature上发表著作报说念了PS1的同源卵白PSH的晶体结构[2]。2014-2015年,先后在Nature报说念了分辨率为4.5 Å以及3.4 Å东说念主源γ-分泌酶的三维结构,第一次报说念了东说念主源γ-分泌酶的冷冻电镜三维重构结构,并分析了γ-分泌酶中催化亚基PS1上的致病突变[4]。2019年,经过近五年的不懈勇猛,分辩在Nature和Science发表论文报说念了γ-分泌酶结合进犯底物Notch和淀粉样前体卵白APP的冷冻电镜结构,分辨率达到了2.7 Å和2.6 Å,这两篇著算作交融γ-分泌酶特异性识别并切割底物的分子机制提供了进犯基础[5,6]。这次运筹帷幄是在之前运筹帷幄基础上γ-分泌酶结构规模的又一次杰出与冲突,为配置以γ-分泌酶为靶点的特异性药物提供了极为进犯的基础。
施一公诠释是该运筹帷幄论文的通信作家,该著作发表在国外著明学术杂志《细胞》(Cell)上。原清华大学结构生物学高精尖革命中心超卓学者,现中国农业大学诠释杨光线、清华大学人命学院助理运筹帷幄员周瑞、清华大学人命学院三年级博士生郭雪飞为论文的共同第一作家。清华大学高精尖革命中心的运筹帷幄员闫创业博士参与了本项责任,清华大学冷冻电镜平台的雷建林博士对数据网罗进行了带领。国度卵白质科学中心(北京)清华大学冷冻电镜平台和清华大学高性能想象平台分辩为该运筹帷幄的数据网罗和数据措置提供了扶助,冷冻电镜平台的李晓敏博士、杨帆博士对数据网罗提供了匡助。北京市结构生物学高精尖革命中心(清华)、科技部国度要点研发磋议、国度当然科学基金、浙江省要点研发磋议为该运筹帷幄提供了经费扶助。
原文蛊卦
1. Yang et al., Structural Basis of γ-Secretase Inhibition and Modulation by Small Molecule Drugs, Cell (2021); https://www.cell.com/cell/fulltext/S0092-8674(20)31621-4
关系论文
2. Li, X., Dang, S., Yan C., Gong, X., Wang, J., Shi, Y. (2013). Structure of a presenilin family intramembrane aspartate protease. Nature 493, 56–61
3. Lu, P., Bai, X.C., Ma, D., Xie, T., Yan, C., Sun, L., Yang, G., Zhao, Y., Zhou, R., Scheres, S.H.W., and Shi, Y. (2014). Three-dimensional structure of human gamma-secretase. Nature 512, 166-170.
4. Bai, X.C., Yan, C., Yang, G., Lu, P., Ma, D., Sun, L., Zhou, R., Scheres, S.H.W., and Shi, Y. (2015b). An atomic structure of human gamma-secretase. Nature 525, 212-21
5. Yang, G., Zhou, R., Zhou, Q., Guo, X., Yan, C., Ke, M., Lei, J., and Shi, Y. (2019). Structural basis of Notch recognition by human gamma-secretase. Nature 565, 192-197.
6. Zhou, R., Yang, G., Guo, X., Zhou, Q., Lei, J., and Shi, Y. (2019). Recognition of the amyloid precursor protein by human gamma-secretase. Science 363.